이 자료는 2017년에 발표된 자료입니다. 내용 중 [번호]는 인용 논문을 표신한 것으로 본 글에서는 생략되었습니다.
포인트
• tDCS는 24시간 동안 향상된 각성을 제공했고 카페인은 12시간 동안 제공했습니다.
• tDCS는 자극 후 6시간 동안 주의 수준을 유지했습니다.
• tDCS는 36시간의 수면 부족 감시 동안 기분을 안정시켰습니다.
• tDCS는 강력한 피로감 해소 대책이 될 수 있습니다.
추상적인
배경
수면 부족으로 인한 피로의 유해한 영향을 개선하기 위해 경두개 직류 자극(tDCS)을 사용하는 효과를 평가하고 이러한 결과를 일반적으로 사용되는 피로 대책인 카페인과 비교합니다.
목적/가설
이전 연구에 따르면 배외측 전두엽 피질(DLPFC)의 tDCS는 주의력과 각성을 조절할 수 있습니다. 저자는 tDCS가 효과적인 피로 대책이 될 수 있다고 가정합니다.
행동 양식
10명의 참가자로 구성된 5개 그룹은 각각 1800에서 활성 tDCS 및 위약 껌, 1800에서 가짜 tDCS가 포함된 카페인 껌, 0400에서 활성 tDCS 및 위약 껌, 0400에서 가짜 tDCS가 포함된 카페인 껌 또는 1800 및 0400에서 위약 껌이 포함된 가짜 tDCS를 받았습니다. 36시간의 지속적인 깨어 있는 동안. 참가자들은 1800시에 시작하여 다음 날 1900시까지 밤새도록 2시간마다 계속되는 경계 작업, 작업 기억 작업, 정신 운동 경계 작업(PVT) 및 절차적 게임을 완료했습니다.
결과
1800에서 투여된 tDCS는 대조군에 비해 향상된 주의 정확도 및 반응 시간을 6시간 제공했습니다. 카페인은 효과를 나타내지 않았습니다. 두 tDCS 그룹 모두 기분에 개선된 영향을 미쳤습니다. tDCS를 받은 참가자는 대조군과 카페인 그룹에 비해 밤새 더 활력이 넘치고 피로감이 적으며 지루함이 덜하다고 보고했습니다.
결론
우리는 tDCS가 강력한 피로 대책이 될 수 있다고 믿습니다. 그 효과는 더 오래 지속되고 기분이 더 긍정적으로 유지되기 때문에 카페인과 비슷하거나 더 유익한 것으로 보입니다.
Fornix Deep Brain Stimulation을 통한 해마 활동 조절
추상적인
배경: Papez 회로 내의 심부 뇌 자극(DBS)은 간질 및 알츠하이머병 치료제로 조사 중입니다. 우리는 이전에 동시 자극 및 기록을 허용하는 만성 이식 가능한 임상 등급 시스템을 사용하여 큰 동물 모델에서 해마 활동에 대한 이 네트워크(전방 시상 핵 및 해마) 내의 노드에서 자극의 효과를 보고했습니다.
목적: 이 연구에서 우리는 해마 내에서 유발전위(EP)와 국부전위(LFP) 활동에 대한 Fornix DBS의 효과를 비교하고 폐쇄 루프 자극을 평가하기 위해 이전 작업을 확장했습니다.
방법: 이미지 유도, 프레임리스 정위를 사용하여 일방적인 뇌궁 및 해마 DBS 리드를 3명의 양 피험자에게 이식했습니다. 뇌궁 및 해마 자극에 대한 반응으로 EP 및 LFP의 만성적이고 깨어 있는 기록을 이식된 장치로 수집하고 오프라인으로 분석했습니다. 결과: fornix의 자극은 강력하고 짧은 잠복기 해마 EP를 생성했습니다. 고주파 fornix 자극은 매개 변수에 따른 효과를 생성했습니다. 낮은 진폭에서 LFP 활동의 짧은 지속 억제가 발생했습니다. 특정 진폭 임계값 이상에서 DBS는 세타 활동의 현저한 폭발을 유도한 다음 해마 활동의 현저한 상태 이동을 이끌어 냈습니다. 이러한 효과는 DBS 후 몇 분 동안 지속되었으며 LFP 스펙트럼 내용 및 위상 진폭 결합의 변화로 반영되었습니다. 이식된 장치를 통한 해마 활동의 실시간 변조는 폐루프 자극을 위한 제어 신호로 LFP를 사용하여 입증되었습니다.
결론: 현재 결과는 이전 발견을 확장하고 이 신경 회로 내에서 DBS에 의해 생성된 대상별 효과를 보여줍니다. 네트워크 활동의 이러한 변화는 임상 조사를 위한 자극 대상 및 매개 변수 선택에 대한 통찰력을 제공할 수 있습니다.
소개
The Circuit of Papez는 다중 변연계 기능을 보조하는 잘 설명된 양방향 신경망입니다 [1,2]. 감정, 기억, 신경생장 기능의 기본 기질로서 간질, 알츠하이머병, 정동 장애를 비롯한 다양한 신경 정신 장애와도 관련이 있습니다. 기저핵 네트워크 내의 심부 뇌 자극(DBS)은 이제 운동 장애에 대한 잘 확립된 치료법입니다. [3] 그리고 그 경험을 바탕으로 다중 신경 경로 및 장애에 대한 적용이 조사 중입니다. Papez 회로 내의 표적에 적용되는 DBS는 간질[4e6], 그리고 최근에는 알츠하이머 치매[7,8] 치료에 대해 평가되었습니다. 수십 년의 연구에도 불구하고 운동 장애에서 DBS의 정확한 작용 메커니즘은 공개된 과학적 질문으로 남아 있으며 [9], 다른 네트워크에서 DBS 효과에 대한 이해는 덜 명확합니다. 우리는 이전에 여러 뇌 위치에서 자극과 기록을 모두 허용하는 양방향 신경 인터페이스를 사용하여 깨어 있고 정상적으로 행동하는 대상의 Papez 회로에서 DBS를 연구하기 위한 대형동물 모델의 개발을 설명했습니다 [10,11]. 이 연구에서 우리는 이 네트워크 내에서 유발전위(EP)를 기록하는 능력을 입증했고, 전방 시상 및 직접 해마 DBS에 대한 반응으로 해마 국소장 전위(LFP)에 대한 고주파 자극의 효과를 평가했으며, 자극에 의해 유도된 해마 흥분성. 현재 연구에서 우리는 알츠하이머 병에 대한 임상 조사 대상 영역인 fornix의 전방 컬럼 영역의 DBS에 대한 네트워크 기능의 유사한 측정을 포함하도록 이 조사를 확장했습니다.
행동 양식
이 작업은 기관 동물 관리 및 사용 위원회에서 승인한 프로토콜에 따라 생리 연구 실험실(Medtronic, PLC; Minneapolis, MN)에서 수행되었습니다. 자세한 수술 및 기록 방법은 이전에 보고되었으며 [12] 여기에 간략하게 요약되어 있습니다. 성인 Polypay 혼합 품종 양(n 3)을 표준 요법으로 마취하고 1.5T MRI를 수집하여 수술 계획 스테이션(Stealth Station Treon, Medtronic, Inc)으로 옮겼습니다. 인간 DBS 수술에 사용되는 유사한 절차에 따라 프레임리스 정위 시스템(Nex-Frame)을 사용하여 일측성 원궁(모델 3389) 및 해마(모델 3387) 사극 DBS 리드를 이식했습니다[13]. 뇌궁 자극에 대한 반응으로 수술 중 해마 EP를 리드 배치를 확인하는 데 사용했습니다. 리드는 견갑골 후 주머니에 터널링 되고 기록 가능하고 충전식 신경 자극기에 연결된 확장에 연결되었습니다 [14,15]. 수술 후 CT 또는 MR 이미지는 DBS 리드의 정위 위치를 확인하기 위해 수술 전 계획 MRI와 병합되었습니다. 이 보고서 당시 피험자의 만성 이식 기간은 다음과 같습니다. C4 e 40개월; C5 ~ 28개월; C6 e 17개월.
자극 및 녹음
신경 기록은 조용한 환경에서 약 2시간 동안 수집되었으며, 피험자는 깨어 있고 기민하며 보행을 제한하는 슬링에서 편안하게 쉬고 있습니다. 시간 영역 신호 및 주파수 대역 전력 측정을 위한 모든 자극 설정 및 기록 매개변수는 맞춤형 프로그래밍 인터페이스 랩탑을 통해 조정되었습니다. 사용자 정의 대역의 LFP 신호 전력 변동은 장치에 의해 A/D 변환기 및 온칩 FFT(무차원)의 최하위 비트(LSB)로 기록되었습니다. 모든 시간 영역 신호는 이식된 장치(500e1000Hz 샘플링 속도, 0.85Hz HP, 450Hz LP 필터)에 의해 기록되었고 저장을 위해 맞춤형 프로그래머에게 실시간으로 스트리밍 되었으며 오프라인에서 분석되었습니다. 네트워크 내의 EP는 일정한 전류의 열차에 의해 도출되었습니다. 임대 자극(5 Hz, 30초 지속 시간, 2e7 mA, 120 us 펄스폭)은 fornix(FX 연락처 0e3) 또는 해마(HC 연락처 8 e11) 리드로 전달되고 다른 리드에서 기록됩니다. 각 피험자에서 가장 큰 해마 EP를 생성하는 fornix 리드의 인접한 양극성 접촉 쌍을 식별하고 이 음극/양극 조합을 후속 장기 테스트에 사용하여 해마 LFP 활동에 대한 자극 효과를 평가했습니다. 폐쇄 루프 자극의 경우 장치에서 낮은 세타 대역 전력을 측정하고 fornix DBS를 트리거하는 제어 신호로 사용했습니다. 폐쇄 루프 알고리즘에 대한 제어 정책을 구현하기 위해 상한 및 하한 전력 임계값과 기간 제약 조건이 설정되었습니다. 자극은 세타 전력이 최소 임계값 아래로 떨어졌을 때 느린 램프 속도로 켜지고 정의된 기간 동안 세타 전력이 상한보다 높으면 꺼졌습니다.
데이터 분석
Acqknowledge 4.1 소프트웨어(BioPac Systems)를 사용하여 전기생리학적 데이터를 분석했습니다. 자극 아티팩트를 트리거로 사용하여 EP를 오프라인에서 평균화했습니다. LFP 스펙트로그램(순간 주파수 대 시간의 강도, Hann 윈도우)은 Sigview32 소프트웨어(v 2.6.1)로 생성되었으며 상대 강도를 나타내는 색상이 있는 대수 Z 축. LFP 신호의 위상-진폭 결합은 설명된 방법[16,17]에 따라 계산되었습니다.
결과
외과 적 타겟팅
이 동물 모델에 대한 초기 연구에서 전방 시상 영역을 대상으로 하는 데 사용된 DBS 리드 궤적과 비교하여 수정된 외과적 접근 방식을 사용하여 fornix 대상에 액세스 했습니다. 이 종에서 fornix는 시상의 전면 및 등 쪽 측면 전체에 걸쳐 확장되는 비교적 큰 구조입니다. 전방-후방 접근법으로 전방 시상에 도달하기 위해서는 DBS 리드로 fornix를 관통해야 합니다. 이 연구에서는 최종 위치가 구조의 전방-등 측 측면에 있도록 DBS 리드를 조밀한 포닉스 백질의 상부 표면을 따라 "스카이빙"하려는 의도로 후방-전방 궤적을 사용했습니다. 그림 1은 수술 전 MR 계획 이미지에 병합된 3389 리드 접촉 어레이(7.5mm)의 위치와 함께 수술 후 CT에서 얻은 한 동물의 리드 위치의 대표적인 예를 보여줍니다. Fornix 리드 궤적과 최종 위치는 3명의 피험자 모두에서 유사했으며, 오름차순 기둥 영역과 일치하며 가장 큰 변화는 등 쪽-복부 축을 따라 관찰되었습니다. 치상회를 가로지르는 해마 리드 접촉 배열(10.5mm)의 위치를 나타내는 대표적인 병합 이미지도 방향을 위한 아틀라스 이미지와 함께 표시됩니다.
유발 전위
fornix 생산 매개 변수의 자극과 해마 활동에 대한 접촉 의존 효과. 강력하고 짧은 대기 시간의 EP는 저주파 포닉스 자극(그림 2)에 대한 응답으로 세 피험자 모두의 해마에 기록되었으며 정확한 리드 배치와 일치하는 낮은 진폭, 양극성 자극으로 유도될 수 있었습니다. 이러한 EP는 더 큰 자극 진폭으로 기본 신경 경로의 모집이 증가함을 나타내는 고전적인 입력-출력 관계를 보여주었습니다. 이러한 반응의 우세한 초기 피크는 자극 개시로부터 약 12~15ms의 대기 시간을 가졌습니다. EP의 더 긴 대기 시간 구성 요소도 피험자 간에 다양한 정도로 나타났습니다. 이러한 해마 EP와 관련된 가능한 구심성 및 원심성 경로를 평가하기 위해 자극 및 기록 부위를 역전시키고 EP를 해마 DBS에 대한 반응으로 fornix 전극에 기록했습니다(그림 3, 상단 패널). 이러한 EP는 fornix DBS(동일한 주제에 대해 중간 패널에 표시됨)에 의해 유도된 해마 EP의 짧은 잠복기 구성 요소와 거의 동일한 잠복기(및 형태)를 가지며, 이는 이들이 동일한 기본 신경 기질의 활성화를 나타냄을 나타냅니다. 양방향 방식으로. 이 주제에서 EP의 두드러지고 더 긴 잠복기 구성 요소가 있었는데, 이는 이전에 보고된 전방 시상 자극에 대한 반응으로 해마 EP의 형태와 잠복기(약간 지연됨) 모두에서 유사했습니다. 연구(하단 패널).
해마 활동에 대한 Fornix DBS 효과
시상 자극에 대한 초기 연구와 직접적인 비교를 제공하기 위해 해마 LFP 활동에 대한 다양한 자극 진폭 및 빈도의 효과를 평가했습니다. 그림 4는 증가하는 진폭의 자극(40Hz)의 10초 램프 시작 버스트에 대한 해마에 기록된 반응을 보여줍니다. 더 낮은 자극 진폭에서 해마 활동의 억제가 있었고 자극 중에 발생한 세타 및 더 높은 주파수 대역에서 분명했지만 이월 효과는 거의 없었습니다. 자극 진폭이 증가함에 따라 이 억제 효과는 그림 4에 제시된 마지막 두 자극에서 볼 수 있는 세타 활동의 임계치 의존적 흥분 폭발로 전환되었습니다. 더 높은 주파수 대역(베타, 감마)이 감소된 낮은 주파수 성분(델타, 세타). 서로 다른 주파수의 Fornix DBS(그림 5)는 유사한 응답 패턴을 생성했으며 자극 진폭의 느린 증가 동안 20Hz 이상의 자극 주파수에서 LFP 억제가 분명했습니다. 이 예에서, 자극 수준이 프로그래밍된 최대값(4mA)에 도달함에 따라 더 높은 DBS 주파수로 생성된 세타 활동의 짧은 버스트(삽입)가 있었고, 이어서 낮은 주파수 LFP 활동이 상승했습니다. 이러한 자극으로 인한 세타 버스트는 오래 지속되는 효과를 가졌습니다. 그림 6에 보다 명확하게 설명된 것처럼 기본 해마 LFP 활동에 대해 설명합니다. 이 예에서 해마 활동의 12분 기간은 피험자가 조용히 쉬고 있는 상태에서 기록되었습니다. 5분의 기준선 기간 후, 해마 세타 버스트를 생성하기 위해 문턱 이상의 수준까지 뇌궁 자극이 천천히 증가했습니다. 자극 진폭이 증가함에 따라 짧은 억제 기간이 관찰된 후 상단 패널 스펙트로그램에서 볼 수 있는 짧은 세타 버스트가 관찰되었습니다. 이 세타 버스트와 자극 중단 후 해마의 LFP 활동은 기준선과 비교하여 현저하게 변화했으며 이러한 패턴은 자극 후 몇 분 동안 지속되었습니다. 전체 시험 기간 동안 관찰된 행동 변화는 없었습니다. 이 그림의 중간 패널은 기준 기간과 자극 후 기간에 대한 평균 파워 스펙트럼의 비교를 보여줍니다. 기준선 동안 우세한 LFP 전력은 델타 대역에 있었습니다. 더 높은 주파수 베타 및 낮은 감마 활동의 버스트가 이 기간 내내 존재했으며, 이는 스펙트로그램에서 더 쉽게 볼 수 있습니다. 자극 유도 세타 버스트에 이어 델타 활동이 증가하고 세타 활동의 강한 밴드가 나타나며 더 높은 주파수에서 동시에 감소합니다. 하단 패널은 이러한 사전 및 사후에 대한 해당 위상-진폭 결합(PAC) 관계를 보여줍니다. 자극 기간. 기준선 동안 세타와 감마 활동, 세타와 높은 베타 밴드, 델타와 낮은 베타 밴드 사이에 강한 PAC가 있습니다. 자극 후 상태에서 증가된 델타 및 세타 전력에도 불구하고 이 네트워크 상태에서 관찰된 고주파 활동의 현저한 감소로 인해 이 PAC의 거의 모든 것이 감소되거나 폐지되었습니다.
해마 활동의 폐쇄 루프 변조
이 연구에 사용된 만성적으로 이식된 양방향 신경 인터페이스는 원격으로 실행되거나 마이크로프로세서 제어 임베디드 알고리즘을 사용하여 폐쇄 루프 기능이 가능합니다 [18]. 시상 및 직접 해마 자극으로 LFP 활동의 폐쇄 루프 변조(억제)를 입증하는 이전 연구를 기반으로, 우리는 반응성 뇌궁 자극으로 해마 세타 전력을 변조(구동)하는 능력을 조사했습니다. 그림 7의 패널은 시간 영역 신호, 제어 대역의 LFP 전력, 높은 베타 - 낮은 감마 대역의 LFP 전력, 자극기의 출력 및 50분 기록 기간 동안의 LFP 스펙트로그램을 보여줍니다. 안정적인 기준선 측정을 설정하기 위한 초기 기간 후에 그림에 표시된 대로 폐쇄 루프 알고리즘이 활성화되었습니다. 이때 세타 전력은 최소 수준 미만이었고 자극 주기가 트리거 되어 자극 진폭의 느린 램프를 시작했습니다. 초기에 자극 수준이 증가함에 따라 스펙트로그램 및 세타 전력 신호에서 입증된 바와 같이 LFP 활동의 억제가 발생했습니다. 예상대로 자극 진폭이 원하는 임계값에 도달하면 강한 세타 버스트가 생성되고 전력 수준이 빠르게 증가하여 상한을 초과하여 자극 주기가 종료됩니다. Theta power는 높게 유지되었고 천천히 감소하기 전에 몇 분 동안 하한선 위에 있었습니다. 반대로, 더 높은 주파수 대역의 전력은 이 시간 간격 동안 천천히 회복되었습니다. LFP 활동에서 유사한 변화 패턴을 생성하는 후속 기간 동안 알고리즘에 의해 자극의 2주기가 추가로 트리거 되었습니다. 그런 다음 폐쇄 루프 자극을 꺼서 자극에서 "씻김"의 시간 경과를 평가했습니다. 자극의 짧은 주기에 의해 유도된 해마 상태 변화는 피험자가 기민하고 활동적이지만(하지만 제한됨) 상당한 시간 동안 지속되었습니다. 세타 밴드 활동은 마지막 자극 후 10분 이상 높은 상태를 유지한 다음 추가 10분 동안 기준선 수준으로 천천히 감소하기 시작했습니다. 더 높은 주파수 대역의 LFP 전력은 자극 후 30분이 지나도 기준선 수준으로 완전히 돌아오지 않은 것처럼 보였지만 병렬로 회복되었습니다.

논의
깨어 있는 대형동물의 만성 기록에서 얻은 현재 결과는 Papez 회로 내에서 DBS의 효과에 대한 추가적인 통찰력을 제공합니다. 보다 구체적으로, 우리의 이전 보고서와 함께, 그들은 이 네트워크 내의 다른 목표에서 자극을 통해 유도될 수 있는 해마 활동에 대한 현저하게 다른 효과를 설명합니다. fornix 표적의 저주파 자극은 해마 내에서 큰 진폭, 짧은 대기 시간 EP를 생성했습니다. 이것들 반응은 3389 리드에서 밀접하게 간격을 둔 인접 양극성 자극을 사용하여 상대적으로 낮은 자극 진폭(1e2 mA)으로 유도될 수 있으며, 이는 인근 신경 집단의 활성화를 시사합니다. 이미징 결과와 함께 이러한 데이터는 Fornix 리드가 정확하게 표적이 되었다는 확신을 제공합니다. 이 초기 반응의 상대적으로 좁은 형태는 백질 경로의 자극과 일치하는 매우 동시적인 방전을 나타냅니다. Fornix는 구심성 및 원심성 축삭 돌기를 모두 포함하지만 이 구조 내의 대부분의 섬유는 해마 형성 [19]에서 유출 섬유를 나타냅니다. 이와 같이, 해마에 기록된 이 짧은 잠복기 EP는 해마 원심성의 항드롬 활성화를 나타낼 가능성이 있습니다. 이 해석은 해마 자극으로 얻은 결과에 의해 뒷받침됩니다(그림 3). 포닉스 전극에 기록된 EP는 유사한 형태와 본질적으로 동일한 대기 시간을 가지며 아마도 동일한 해마 섬유에서 정형 전파를 반영합니다. 약 15ms의 응답 대기 시간은 최소 경로 거리 20mm(두 전극 사이의 선형 거리) 및 예상 경로 거리를 기준으로 1 e3 m/s 범위의 전파 속도에 해당합니다. 40mm(MRI에서 측정). 이 전도 속도 범위는 포유류 중추 신경계의 축삭 경로에 대해 보고된 전파 속도와 일치합니다 [20]. 포닉스 표적에서 이들 섬유의 자극은 파페즈 유두 경로, 전방 핵을 통해 정위적으로 해마(짧은 잠복기 반응)로 역방향으로 전파되고 대상을 통해 해마로 다시 전파되는 활동을 생성할 것입니다. 그림 3(가운데)에 표시된 더 긴 대기 시간 응답은 형태의 유사성과 전방 시상 자극에 의해 생성된 해마 EP와 비교하여 약간 지연된 대기 시간(~20ms)을 기반으로 유발 활동의 정위적 전파를 반영할 수 있습니다. 그림 3, 하단). 이러한 결합된 대기 시간은 이 신경 회로에 대해 70~80ms 범위의 "왕복" 전파 시간을 초래하며, 이는 동일한 네트워크 노드[미공개 데이터]에서 기록되고 생성된 EP로부터 이 네트워크에서 측정된 공진과 일치합니다. Talakoubet al. [21] 한 영장류 대상에서 뇌궁 자극에 의해 유발된 해마 EP를 설명했습니다. 관찰된 다중 응답 피크의 형태 및 대기 시간은 그림 3(중간)의 것과 매우 유사했습니다. 뇌궁 자극에 대한 유발 반응은 침습성 간질 모니터링을 받는 인간에서도 기록되었습니다. Milleret al. [22]는 자극 부위가 훨씬 더 후방에 있었지만 우리 동물에서 관찰된 초기 잠복기 피크와 일치하는 6~20ms의 초기 잠복기를 가진 4명의 피험자에서 큰 진폭의 해마 EP를 보고했습니다. 해마 반응 외에도 Koubeissi et al. [6] 또한 위에서 설명한 대로 유발된 활동의 양방향 전파를 제안하는 후방 대상에 EP를 기록했습니다.
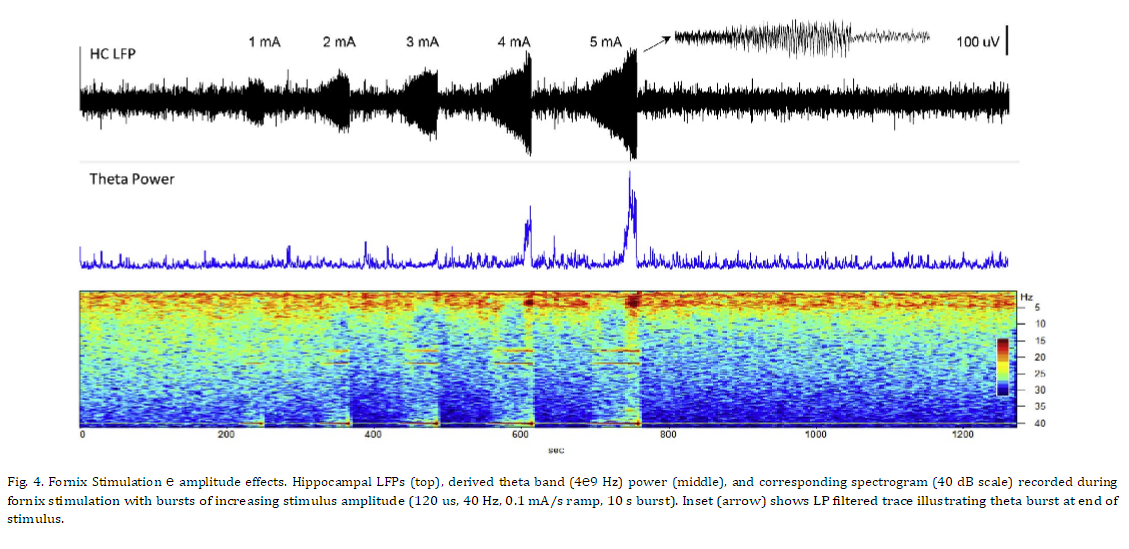
fornix의 더 높은 주파수 자극은 해마 LFP 활동에 대한 진폭 의존 효과를 생성했습니다. 낮은 자극 진폭에서 자극 동안 관찰된 우세한 효과는 낮은 주파수 대역에서 활동의 억제였습니다. EP 데이터에 기초하여, 이러한 자극 수준에서 발생하는 기본 신경 활성화는 아마도 해마 원심성의 항드롬 활성화를 반영합니다. 만약 이것이 사실이라면, 관찰된 억제는 해마 유출 뉴런의 세포체 근처의 재발성 측부(collaterals)의 역방향 침입과 억제성 중간뉴런의 활성화의 결과일 수 있으며, 이는 McCracken et al. [23] 선조체 DBS에 대한 반응으로 안와 전두엽 피질에서. Spencer와 Kandel [24]은 고양이의 청각 장애가 있는 뇌궁의 자극으로 인한 해마 단일 단위에서 지속적인 억제 반응을 보고했으며, 이는 제안된 메커니즘과도 일치합니다. 대안적으로, 이 경로에서 정형외과적 활동은 전방 시상 자극에서 보이는 것과 유사한 해마 억제를 생성했을 수 있지만, 억제의 시간 경과는 달랐고, fornix DBS로 자극 후 이월이 거의 없었습니다. 이러한 억제 효과의 주파수 의존성은 시상 및 직접 해마 DBS에서 관찰된 것과 매우 유사했으며, 20 e40 Hz 범위에서 발생하는 LPF 활성의 명확한 억제가 있습니다.
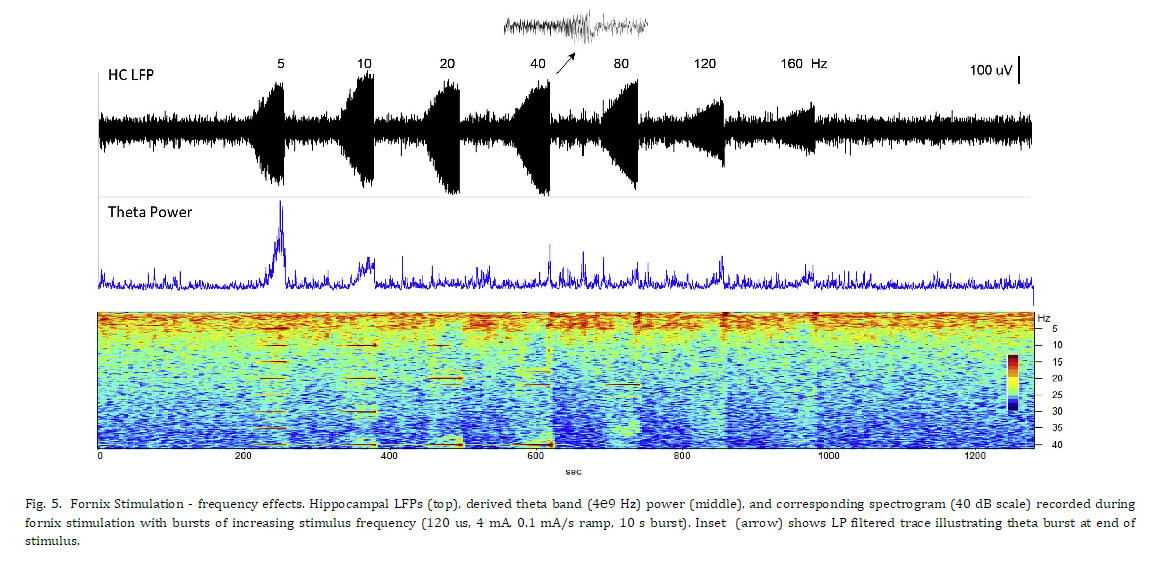
이 조사에서 더 흥미로운 관찰 중 하나
더 높은 진폭의 포닉스 자극에 의해 생성된 해마 세타 활동("세타 버스트")의 임계값 의존 버스트였습니다. 또한, 해마 패턴의 뚜렷한 변화 이러한 폭발 이후 분명한 활동과 지속 시간은 다소 주목할 만했습니다. 그림 6에서 볼 수 있듯이 매우 짧은 DBS 유도 버스트는 LFP 스펙트럼에 극적인 변화를 가져왔고 이 짧은 이벤트 이후 몇 분 동안 지속되었습니다. 네트워크 "상태"의 이러한 현저한 변화는 스펙트럼 LFP 전력의 패턴뿐만 아니라 theta-gamma PAC와 같은 로컬 네트워크 기능의 보다 복잡한 측정에도 반영되었습니다. PAC의 이러한 변화가 교차 주파수 결합 메커니즘의 변경을 반영했는지 또는 단순히 고주파 활동의 전반적인 감소로 인한 것인지는 확실하지 않습니다. 이러한 사건을 불러일으키는 명확하고 반복 가능한 역치 의존성에 기초하여 기본 메커니즘은 원궁 내 특정 신경 집단의 활성화를 포함하는 것으로 보입니다. 알려진 해부학 및 생리학을 고려할 때, 그러한 효과를 도출할 가능성이 가장 높은 후보는 내측 중격 및 대각선 밴드 영역에서 발생하는 경로일 것입니다. 이 핵은 해마에 직접 콜린성 및 횡격막 돌기를 보내며 세타 리듬의 생성에 관여하는 것으로 알려져 있습니다 [25,26]. 이러한 구조의 파괴 또는 약리학적 차단은 해마 세타 활동의 감소와 기억 관련 작업의 성능 저하를 초래합니다 [27,28]. 행동적으로, 피험자들은 관련된 명백한 변화를 보이지 않았습니다. DBS에 의해 유도된 다른 해마 네트워크 상태와 함께. 도시된 바와 같이, 3마리의 동물 모두 fornix DBS에 대한 반응으로 해마에서 강한 EP를 나타내었고 또한 고주파 자극 동안 LFP 활성을 억제하였다. 한 주제에서 우리는 더 높은 자극 진폭으로 세타 버스트 현상을 유도할 수 없었지만 흥미롭게도 이 동물에서는 반복 가능한 임계값 의존 행동 이벤트인 배변을 유발했습니다. 세타 버스트 사건과 유사하게, 자극으로 이 역치 의존적 행동을 유발하는 능력은 특정 신경 경로의 모집을 시사하며, 이 경우에는 부교감 신경 조절에 관여하는 전방 시상하부 영역[29]에 대한 투사를 포함할 가능성이 있습니다. Hess [30]는 깨어 있는 동물에서 이 영역의 광범위한 미세자극 매핑을 수행했으며 시상하부 및 중격 영역과 관련된 자극 유발 결함 행동을 보고했습니다. 포닉스 내 축삭 경로의 다양한 하위 집단에 비해 DBS 리드 위치의 작은 변화가 피험자 간의 이러한 반응 차이를 설명할 가능성이 있습니다.

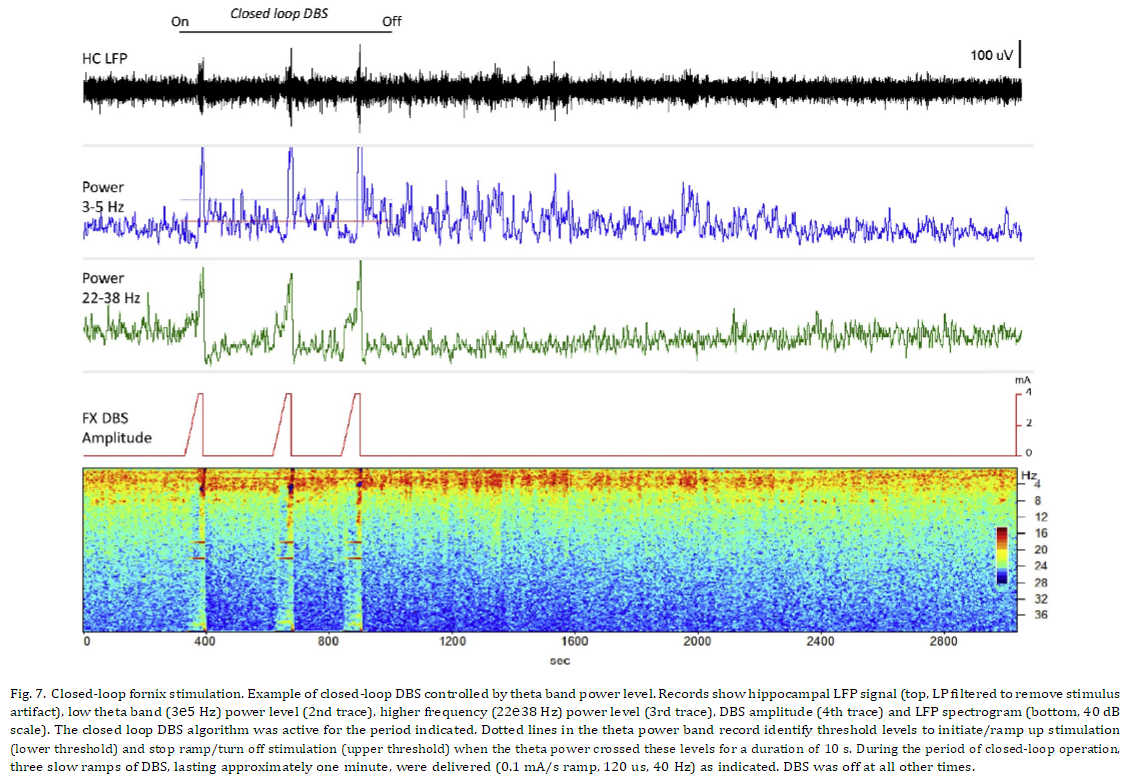
Fornix DBS는 비만 치료를 받고 있는 피험자에서 자극 유발 기억의 초기 관찰을 기반으로 알츠하이머병 치료제로 조사 중입니다 [31]. 이 초기 관찰에 이어 경미한 알츠하이머 환자의 fornix DBS에 대한 6명의 피험자 파일럿 연구가 이어졌습니다 [7]. 6명 중 2명의 피험자에서 자극이 5e6V의 "상대적으로 높은" 수준으로 전달되었을 때 자서전적 기억과 관련된 유사한 역치 의존 현상이 보고되었습니다. 우리 동물에서 관찰된 후속 네트워크 상태 변화는 이러한 임상 경험의 전기생리학적 상관관계를 나타낼 수 있습니다. 이 연구에 사용된 장치는 인간 대상에서 신경망 활동과 DBS에 의해 유도된 변화를 만성적으로 기록할 수 있는 기회를 제공합니다. 증상 상태, 임상적 개선 또는 다양한 장애의 특정 행동 사건과 관련된 네트워크 활동을 관찰할 수 있는 능력을 갖추면 궁극적으로 DBS 요법으로 결과를 개선해야 합니다. 서로 다른 네트워크 장애에서 원하는 상태에 대한 근본적인 이해는 결국 적응형 DBS 알고리즘의 개발을 지원하여 신경 활동을 특정 범위로 보다 정확하게 조절합니다. 우리는 이전에 Papez 네트워크의 활동을 억제하고 해마의 흥분성을 정의된 수준으로 감소시키는 것이 가능하다는 것을 입증했습니다. 직접 해마 또는 전방 시상 DBS를 사용하여 둘 다 간질 치료를 위해 조사 중입니다. 이러한 효과는 운동 장애에 일반적으로 사용되는 연속 고주파 자극과 비교하여 저주파(40~50Hz) 폐쇄 루프 자극으로 얻을 수 있으며 일반적으로 새로운 DBS 적응증의 거의 모든 조사에 채택됩니다. 그림 7에 표시된 예는 유사한 자극 매개변수와 폐쇄 루프 fornix DBS를 사용하여 이 네트워크에서 활동을 구동하는 것도 가능함을 보여줍니다. 낮은 자극 수준에서 억제가 발생하는 이 흥분 효과의 신중한 진폭 의존성은 특히 급성 임상 반응이 쉽게 나타나지 않는 상황에서 매개변수 적정 중에 신경 활동에 대한 DBS 효과를 직접 관찰할 수 있는 가치를 분명히 강화합니다. 현재 작업은 이러한 관찰에 분명한 한계가 있습니다. 상대적으로 적은 수의 피험자 집단에서 나온 것입니다. 그러나 보고된 결과는 깨어 있는 대형동물에서 수년간의 만성 기록에 걸쳐 도출되었으며 DBS에 대한 반응으로 신뢰할 수 있고 반복적인 측정을 나타냅니다. 또한 본질적으로 동일한 실험적 접근 방식을 사용하는 이전 연구의 결과는 Papez 회로의 특정 대상에서 DBS에 의해 생성된 해마 활동에 대한 다양한 효과를 강조하는 비교자를 제공합니다. 이 모든 작업은 일반 동물에서 수행되었으며 만성 질환 모델, 따라서 임상 분야에 대한 외삽법은 빈약합니다. 그러나 정상 상태에서 서로 다른 네트워크가 DBS에 어떻게 반응하는지 정의하는 것은 병태생리학적 조건에서 DBS 요법의 작용 메커니즘을 더 잘 이해하는 데 근본적인 것으로 보이며 표적 및 자극 매개변수 선택에 대한 통찰력을 제공할 수 있습니다. 결론적으로 설명된 결과는 Papez 회로에만 해당되지만 이 대형 동물 모델은 DBS 효과를 탐색하기 위한 프로토타입 네트워크 및 차세대 기술을 위한 테스트 베드 역할을 할 수 있습니다. 이러한 관점에서 이러한 연구는 LFP를 폐쇄 루프 제어 신호로 사용하여 완벽하게 이식 가능한 DBS 시스템을 통해 실시간으로 네트워크 활동을 궁극적으로 모니터링하고 원하는 엔드포인트로 변조할 수 있는 잠재력을 입증했습니다. 기저핵 LFP 바이오마커를 기반으로 인간 피험자에서 파킨슨병에 대한 폐쇄 루프 DBS의 초기 시연이 여러 그룹에서 보고되었습니다 [32 e34]. 지금까지 이러한 연구는 DBS 리드에 대한 경피적 접근을 필요로 하는 외부 기반 제어 시스템을 사용하여 상대적으로 짧은 기간 동안 병원 내에서 엄격하게 수행되었습니다. 여기에 사용된 이식형 시스템의 인간 사용에 대한 초기 보고서는 최근에 나타났으며 다양한 장애의 여러 DBS 표적에서 만성 LFP 기록을 설명합니다 [35 e39]. 이 시스템을 사용하는 인간 대상에서 폐쇄 루프 DBS의 초기 파일럿 조사가 현재 진행 중입니다.
'건강' 카테고리의 다른 글
| [건강] 발달장애 아이(15년 10월생) 관찰 일기 (0) | 2024.04.04 |
|---|---|
| [뇌 건강 관련 자료] 지능과 뇌 신경 유레카 부분에 대한 연구 (0) | 2024.03.02 |
| [뇌 건강 관련 자료] 경두개 전기 자극 기법이 어휘 학습에 긍정적인 영향을 준다. (0) | 2023.08.18 |
| [뇌 건강 관련 자료] 우측 배외측 전두엽 피질에 tDCS 양극 자극을 주면 실제 문제 해결에서 창의적 성능 향상 효과를 줄수 있음. (0) | 2023.08.18 |
| [뇌 건강 관련 자료] 뇌졸증 후 환자의 신경 재활시 비침습적 뇌 자극에 따른 효과 향상 연구 자료 (0) | 2023.08.18 |



댓글